Информационные материалы
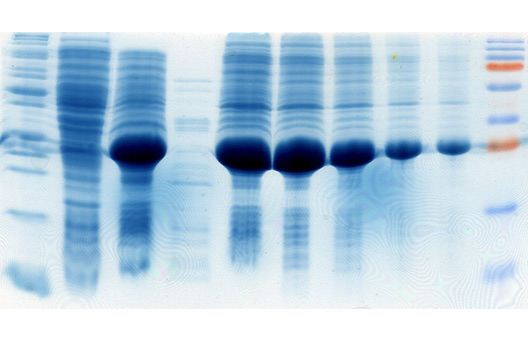
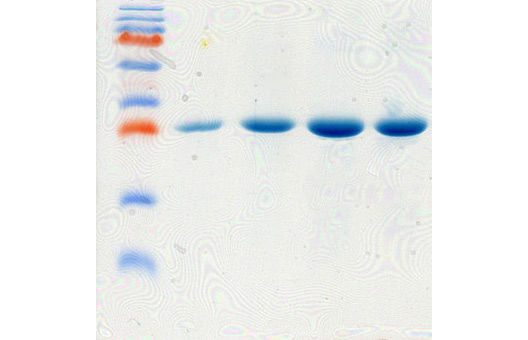
Гетерологичная экспрессия генов в клетках грамотрицательных бактерий E. coli является одним из наиболее эффективных способов получения рекомбинантных белков ввиду хорошо изученной генетики данного микроорганизма, доступности удобных экспрессионных векторных систем и штаммов хозяина, простоты в использовании; низкой цены и высоких уровней экспрессии целевого гена, достигающих 40-45% от общего клеточного белка (Hannig и Makrides, 1998; Baneyx, 1999).
Однако, несмотря на большое количество достоинств E.coli, далеко не всегда можно рутинным способом получить высокий уровень экспрессии целевого гена в данной системе. Среди множества причин, препятствующих эффективному гетерологичному продуцированию рекомбинантного белка в E.coli, можно выделить предпочтение в использовании кодонов, G+C состав экспрессируемого гена, стабильность мРНК, растворимость белка, его токсичность для бактериальных клеток. Использование природных (нативных) генов, в частности вирусных, в гетерологичной экспрессии в клетках E.coli бывает связано с низким уровнем экспрессии (Jana и Deb, 2005).
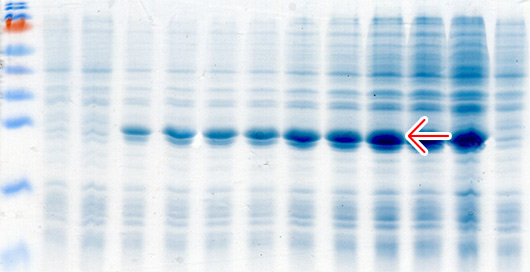
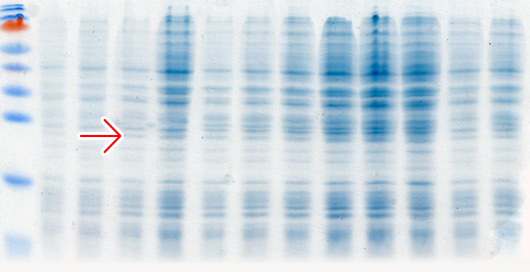
Кроме классической индукции экспрессии с использованием ИПТГ мы используем автоиндукцию экспрессии генов с использованием 0.2% лактозы по методу Штудиера (Studier, 2005). Данный метод индукции экспрессии является более простой, эффективной и недорогой альтернативой классической индукции с использованием ИПТГ в системах экспрессии, основанных на лактозном опероне. При использовании автоиндукции не требуется ни следить за оптической плотностью культуры клеток, ни добавлять индуктор. От момента инокуляции колонии в автоиндукционную среду до получения биомассы бактерий с ОП600=7-15 с синтезированным целевым белком проходит 15-20 часов. Феномен автоиндукции экспрессии основан на механизмах, которые бактерии используют для регуляции использования источников углерода и энергии, находящихся в питательной среде. Если в питательной среде присутствует глюкоза, то катаболическая репрессия и исключение индуктора препятствуют поглощению лактозы lac пермеазой, которая является продуктом гена lacY (Meadow et al., 1990; Saier и Crasnier, 1996; Inada et al., 1996; Kimata et al., 1997). Когда ресурсы глюкозы исчерпываются, лактоза начинает поглощаться lac пермеазой, внутри бактериальной клетки бета-галактозидаза превращает лактозу в естественный индуктор – аллолактозу (Beckwith, 1987; Huber et al., 1976). Использование в качестве источника углерода и энергии химического вещества, не связанного с индукцией и лактозным опероном (например, глицерол), позволяет практически удвоить выход целевого белка в сравнении с эквивалентными количествами лактозы, как первичного источника энергии. Это связано с тем, что Т7 РНК-полимераза настолько активна, что индукция может направить большую часть клеточной транскрипции и трансляции на продукцию целевого белка (Studier и Moffatt, 1986), которая может перекрываться со способностью метаболизировать лактозу для энергетических нужд. Глицерол не перекрывается с индукцией целевого белка и служит эффективным источником углерода и энергии. Присутствие в среде для автоиндукции 0,05% глюкозы ускоряет процесс роста бактериальных клеток на начальных стадиях и одновременно блокирует индукцию 0,2% лактозой, присутствующей в среде, а 0.5% глицерол, также присутствующий в среде, является эффективным источником углерода и энергии.