Создание гибридом.
Получение поликлональных
и моноклональных антител
Получение поликлональных
антител
Стоимость наработки зависит от структуры антигена и необходимости его производства, вида иммунизируемого животного, необходимости хроматографической аффинной антиген специфической очистки антител и их анализа. Обсуждается с Заказчиком индивидуально.
Go to detailed descriptionСоздание гибридом. Получение
моноклональных антител
Стоимость создания гибридом и получения моноклональных антител зависит от структуры антигена и необходимости его наработки, сложности и наличия методики отбора гибридом, продуцирующих антитела необходимых свойств, количества гибридом, продуцирующих антитела к разным эпитопам, необходимости наработки моноклональных антител в асцитах и их хроматографической очистки. Обсуждается с Заказчиком индивидуально.
Go to detailed descriptionwe pick up optimal solution for your task in accordance with world practice and affordable budget:
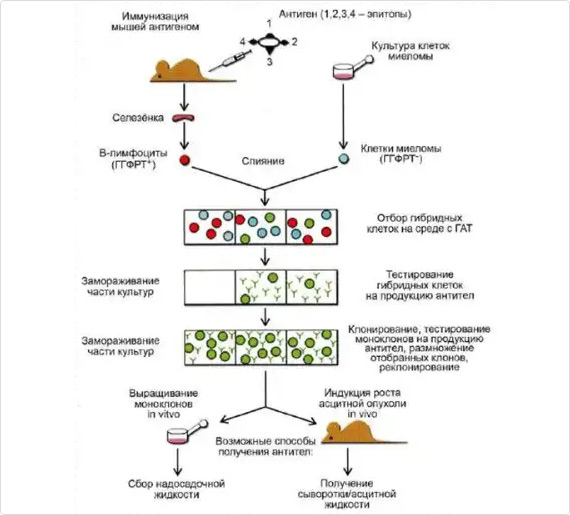
Основные этапы получения моноклональных антител
Для иммунизации мы используем инбредную линию мышей BALB/c (питомник лабораторных животных «Пущино»). Схема иммунизации составляется с учетом природы антигена, к которому необходимо получить моноклональные антитела, и его иммуногенности. Если антиген обладает токсичностью, то вначале определяется нетоксичная доза антигена. Схема иммунизации подбирается с учетом особенностей метаболизма антигена и его иммунных свойств. При разных схемах иммунизации на начальном этапе выбранная доза антигена обычно вводится подкожно в заднюю лапу животного в количестве 30-50 мкл с использованием полного адъюванта Фрэйнда (ПАФ) 1:1 с фосфатно-солевым буфером (ФСБ). Затем для иммунизации уже используется неполный адъювант Фрэйнда (НАФ). В последующие иммунизации используемое количество антигена в ФСБ вводится внутрибрюшинно в количестве 200-300 мкл. При этом, контролируется титр вырабатываемых антител в сыворотке животного путем забора крови из супраорбитального синуса или хвостовой вены и постановки непрямого твердофазного иммуноферментного анализа (ИФА). Когда титр антител достигает нужных значений, проводится бустирование мыши антигеном в ФСБ внутрибрюшинно в течение 3-х дней. Далее животное с хорошим титром антител умерщвляют путем цервикальной дислокации и производят забор селезенки.
Для получения гибридом, продуцирующих антитела, используют спленоциты иммунизированых мышей линии BALB/c и клетки миеломы Sp2/0 Ag14. Клетки миеломы и спленоциты в соотношении 1:1 обрабатывают 40-50% раствором полиэтиленгликоля (ПЭГ, Sigma). После проведения слияния проводят селекцию от неслившихся клеток путем использования ростовой среды ДМЕМ с 15% фетальной бычьей сывороткой и добавлением гипоксантина, аминоптерина и тимидина (ГАТ). Клетки рассевают на культуральные 96-луночные планшеты. Далее селекцию ведут на среде с добавлением гипоксантина и тимидина (ГТ).
Клетки из лунок с положительным сигналом в ИФА далее клонируют на 96-луночные планшеты по 200 клеток на планшет, для подтверждения моноклональности культур. После тестирования всех клонов предполагаемой моноклональной культуры, в случае, если все субклоны позитивные, моноклональность культуры считается подтвержденной. Подтвержденные моноклональные культуры выводят в массовую культуру.
Наиболее широко используются сейчас два способа наработки гибридомных клеток и моноклональных антител: наработка на культуральных средах в СО2 -инкубаторе и в асцитных жидкостях мышей. Каждый из них имеет свои достоинства и недостатки. Наработка антител в культуральных средах – более длительный и трудоемкий процесс. Для наработки большого количества требуемых антител мы используем животных (мышей линии BALB/c). За неделю до введения клеток, мышам линии BALB/c внутрибрюшинно вводят Pristane, адъювант, оказывающий стимулирующее действие на образование асцитных опухолей, в объеме 200 мкл. Затем отмытые в ФСБ гибридомные клетки вводят внутрибрюшинно мышам в количестве от 500 тыс до 1 млн клеток. Через 2-4 недели из брюшной полости мышей забирают асцит, содержащий моноклональные антитела.
Выделение и очистку моноклональных антител из асцитической жидкости мышей проводят путем осаждения каприловой кислотой с последующей хроматографией, что обеспечивает высокую чистоту продукта.
В целом, получение моноклональных антител – это довольно длительный и трудоемкий биотехнологический процесс. Однако, большим преимуществом моноклональных антител является их высокая специфичность к конкретному антигену, что очень важно при разработке иммуноферментных систем. Полученные нами моноклональные антитела затем используются в качестве основных компонентов наших тест-систем, что гарантирует высокое качество продукции компании и пластичность процесса производства.
Получение поликлональных антител
В нашей лаборатории также можно получить поликлональные кроличьи антитела к конкретному антигену, для чего используются кролики породы Шиншилла. Схема иммунизации также подбирается с учетом природы антигена, особенностей его метаболизма и иммунных свойств. Обычно, иммунизацию проводят троекратно, с интервалами в 2-3 недели. Первую проводят в ПАФ подкожно в 5 разных точек, а последующие в НАФ. Через 2 недели после 3-й иммунизации из краевой ушной вены забирают кровь у животного для определения титра антител к антигену методом твердофазного иммуноферментного анализа. Дальнейшую схему иммунизации определяют, исходя из полученного титра антител. Когда титр антител удовлетворяет желаемому, всю кровь животного забирают. Очистку поликлональных антител из полученной сыворотки проводят хроматографически, что обеспечивает высокую чистоту продукта
Поликлональные антитела мы также используем при разработке иммуноферментных тест-систем. Использование поликлональных антител совместно с моноклональными антителами к конкретному антигену повышает чувствительность тест-систем, что определяется наличием в кроличьей сыворотке антител к большому количеству различных эпитопов антигена.<
Основные этапы получения поликлональных антител
Для иммунизации мы используем инбредную линию мышей BALB/c (питомник лабораторных животных «Пущино»). Схема иммунизации составляется с учетом природы антигена, к которому необходимо получить моноклональные антитела, и его иммуногенности. Если антиген обладает токсичностью, то вначале определяется нетоксичная доза антигена. Схема иммунизации подбирается с учетом особенностей метаболизма антигена и его иммунных свойств. При разных схемах иммунизации на начальном этапе выбранная доза антигена обычно вводится подкожно в заднюю лапу животного в количестве 30-50 мкл с использованием полного адъюванта Фрэйнда (ПАФ) 1:1 с фосфатно-солевым буфером (ФСБ). Затем для иммунизации уже используется неполный адъювант Фрэйнда (НАФ). В последующие иммунизации используемое количество антигена в ФСБ вводится внутрибрюшинно в количестве 200-300 мкл. При этом, контролируется титр вырабатываемых антител в сыворотке животного путем забора крови из супраорбитального синуса или хвостовой вены и постановки непрямого твердофазного иммуноферментного анализа (ИФА). Когда титр антител достигает нужных значений, проводится бустирование мыши антигеном в ФСБ внутрибрюшинно в течение 3-х дней. Далее животное с хорошим титром антител умерщвляют путем цервикальной дислокации и производят забор селезенки.
Для получения гибридом, продуцирующих антитела, используют спленоциты иммунизированых мышей линии BALB/c и клетки миеломы Sp2/0 Ag14. Клетки миеломы и спленоциты в соотношении 1:1 обрабатывают 40-50% раствором полиэтиленгликоля (ПЭГ, Sigma). После проведения слияния проводят селекцию от неслившихся клеток путем использования ростовой среды ДМЕМ с 15% фетальной бычьей сывороткой и добавлением гипоксантина, аминоптерина и тимидина (ГАТ). Клетки рассевают на культуральные 96-луночные планшеты. Далее селекцию ведут на среде с добавлением гипоксантина и тимидина (ГТ).
we pick up optimal solution for your task in accordance with world practice and affordable budget:
Информация по созданию гибридом и получению моноклональных антител
Технология получения гибридом – клеток, продуцирующих моноклональные антитела, впервые была описана в 1975 году Келером и Мильштейном. Гибридные клетки получали путем слияния мутантных клеток плазмацитом и спленоцитов мышей, иммунизированных эритроцитами барана. В качестве индуктора слияния клеток использовали вирус Сендай. Гибридные клетки культивировали в полужидком агаре, содержащим метаболические ингибиторы опухолевых клеток. Таким образом, клетки, получившие ген, кодирующий недостающий фермент, активно пролиферировали, наряду с лимфоцитами из селезёнки. Однако, последние погибали в силу ограниченности срока их деления.
С развитием гибридомной технологии методика претерпела существенных изменений. В качестве индуктора слияния клеток в современных работах используется полиэтиленгликоль. На смену полужидкому агару пришла техника лимитирующих разведений. Еще одним направлением развития данной технологии стало создание и оптимизация клеточных линий плазмацитом. Большинство культивируемых клеточных линий плазмацитом были созданы в рамках исследований Национального института здоровья в США, посвященных изучению структур и функций иммуноглобулинов. Интересно, что практически все используемые для создания гибридом, продуцирующих моноклональные антитела, клеточные линии, были получены из штамма плазмацитомы MOPC21, индуцированных у мышей линии BALB/C. Название происходит от способа индукции плазмацитомы – MOPC – mineral-oil- induced plazmacytoma. Однако, для использования этих клеточных линий необходимо было преодолеть ряд препятствий. Так, плазмацитомы, будучи клетками с высоким уровнем дифференцировки, обладают слабой способностью к росту вне организма. Поддержания культуры клеток стало возможным при использовании различных ростовых факторов, источником которых могут быть перитонеальные макрофаги, спленоциты или сыворотка крови мышей, иммунизированных полным адъювантом Фрейнда. Культивируемую линию выводили чередованием культивирования in vitro и пассированием в сингенных мышах. В результате многочисленных попыток была получена клеточная линия P3K. Дальнейшая работа по выведению гибридомных клеточных линий была связана с разработкой оптимальной методики метаболической селекции. В основе метода лежит возможность использования нормальными соматическими клетками двух путей синтеза нуклеотидов. Для селективного отбора сначала блокируют с помощью метаболических ядов основный тип синтеза, где предшественниками нуклеотидов являются аминокислоты и углеводы. Если же клетки дефицитны по ферментам второго (запасного) пути синтеза нуклеотидов, то она гибнет. От гибели клетку может спасти гибридизация с клеткой, содержащей дефицитный ген. Этот принцип лег в основу метода получения гибридомных клеточных линий.
Существенным этапом в становлении гибридомной технологии стало создание штаммов плазмацитом, лишенных способности продуцировать иммуноглобулины и их фрагменты. Для этого плазмацитомы обрабатывали сыворотками к мышиным иммуноглобулинам, отбирали и клонировали клетки, не продуцирующие Ig.
На данный момент выведено множество линий клеток плазмацитом: X63Ag8.653, NSO, SP-2/O-Ag14. Все они различаются по способности производить после слияния стабильные клоны, продуцирующие значительные количества моноклональных антител. Гибридомы X63, NSO, получаемые из исходных миеломных клеток – стабильнее чем те, что являются гибридными производными. Однако, все эти линии имеют существенный общий недостаток – острая необходимость в присутствии экзогенных ростовых факторов. Чаще всего применяют коровьи эмбриональные сыворотки. Реже используют сыворотки других животных, в частности сыворотку пуповинной крови человека. Работа с сыворотками вносит и негативный вклад в методику, так как создаёт необходимость тщательного контроля контаминации микоплазмами, которые конкурируют с клетками за предшественников нуклеотидных оснований.
Важным этапом создания гибридом является эффективная иммунизация животных. На титр антител может влиять как природа антигена, так и генотип животного. Успех иммунизации определяется рядом факторов: свойствами иммуногена, сочетанием с адъювантами или носителями. Так, полный адъювант Фрейнда применяют для получения иммунного ответа на целый спектр антигенов и коиньецируемых примесей. Однако, его применение имеет ряд побочных эффектов, в частности – болезненные очаги воспаления, чего не наблюдается при иммунизации с неполным адъювантом Фрейнда. Если же целью является получение иммуноглобулинов класса E, то в качестве адъювантов используют алюмокалиевые квасцы. Для получения высокого титра антител необходимо оптимизировать также схему иммунизации. Известными фактом является то, что с увеличением длительности стимуляции антигеном увеличивается аффинность, получаемых моноклональных антител, но снижается олигоклональность иммунного ответа (происходит ответ только на доминантные эпитопы). Следует помнить, что частые повторные введения антигена ведут к снижению ответа до фонового уровня. Однако, имеет смысл увеличить концентрацию антигена у животных непосредственно перед взятием у них лимфоидных клеток. Еще одним способом увеличить выход моноклональных антител является использование механизма адаптивного переноса спленоцитов от иммунизированных мышей облученным реципиентам. Таким же образом пытались изменить спектр специфичности антител.
Эффективная иммунизация помимо всего вышеперечисленного опосредована генотипом иммунизируемых животных. Общепринятым ныне является подход с использованием генетически инбредных линий мышей Balb/C, как для иммунизации, так и для получения культивируемых линий плазмацитом. Очевидным плюсом его является разрешение проблемы гистосовместимости, минусом – сужение спектров эпитопов, распознаваемых получаемыми моноклональными антителами.
Приняв во внимание все ключевые моменты эффективной иммунизации и получив необходимый титр антител, переходят к этапу получения спленоцитов и их слиянию. В качестве источника лимфоцитов обычно используют селезенку, реже лимфоузлы или костный мозг.
Перед слиянием клеток их обогащают плазмобластами. Для этого существует несколько различных подходов. Наиболее простой заключается в повторном введении антигена в течение нескольких дней предшествующих получению клеток. Другой подход состоит в использовании различных манипуляций с лимфоидными клетками in-vitro с целью обогащения суспензии плазмобластами. К примеру, предварительное выделение клеток с плавучестью 1,06-1,07 на градиенте Percoll существенно увеличивало выход гибридом, продуцирующих моноклональные антитела. Сегодня для выделения специфических лимфобластов используют клеточный сортер. Для повышения выхода гибридом используют миеломные клетки, нагруженные специфическим антигеном, что приводит к образованию контактов между опухолевыми клетками и антиген-специфичными плазмобластами.
Подготовка плазмацитомы к слиянию заключается в выбраковке ревертантов из гомогенной синхронизированной культуры в логарифмической фазе роста; проверка её соответствия основным параметрам; рассеивание её с максимальной частой и поддержание её постоянной пролиферации.
Гибридизацию лимфобластов и плазмацитомы проводят путем клеточного слияния, опосредованного различными агентами, приводящими к изменению мембран, формированию цитоплазматических контактов и формированию дикарионов. Для индукции гибридизации используют несколько различных подходов. Первым изученным и вошедшим в практику было использование вируса Sendai, посредством вовлечения клеточных рецепторов, липидных компонентов мембран, гликопротеидов вируса. Этот подход имел ряд недостатков, связанных с воспроизводимостью результатов и жизнеспособностью гибридов. Альтернативным агентом является ПЭГ. Механизм слияния, индуцированного ПЭГ до конца не раскрыт. Для слияния используют ПЭГ с ММ 1000-4000 и концентрацией 30-55%. Сегодня появился более современный способ индуцировать слияние клеток – подвергнуть их воздействию электрических импульсов. В результате слияния получают несколько типов дикарионов. Для отбора интересующего дикариона (лимфобласт-миелома) используют ростовые среды, содержащие, помимо аминоптерина, гипокстантин и тимидин, которые опосредуют альтернативный путь синтеза ДНК. Таким образом, в ходе селекции выживают дикарионы, возникшие в результате слияния а) двух лимфобластов и б) лимфобласта и плазмацитомы. Первые быстро погибают ввиду ограниченности пролиферативного потенциала. Остаются целевые гибридные клетки. Данная схема имеет множество модификаций в отношении культивирования. Для культивирования можно использовать мягкий агар с уже включенными селектирующими агентами, либо жидкую селективную среду в 96 луночном планшете, либо же культивирование клеток проводят в условиях массовой среды, с их последующим переносом в селективную среду в 96-луночном планшете.
Помимо селективных агентов в питательные среды добавляют ростовые факторы, так как клетки мышиных плазмацитом и полученные из них гибриды нуждаются в присутствии ростовых факторов, в частности IL6. Для этого в среду помимо сыворотки добавляют кондиционированные среды – надосадочные жидкости, полученные при культивировании первичных клеточных культур, чаще перитонеальных макрофагов.
Еще одна стратегия по увеличению выхода гибридом, заключается в совместном рассевании гибридных клеток с другими клетками, к примеру, тимоцитами мышей, облученными ксеногенными или аллогенными фибробластами. Предполагается, что помимо создаваемого эффекта клеточной массы благоприятное влияние могут оказывать продуцируемые такими клетками различные цитокины. Если же в качестве таких клеток использовать перитонеальные макрофаги, то они будут выполнять крайне важную функцию расчистки культур от погибающих клеток.
Итак, дальнейшим этапом является скрининг гибридов-продуцентов моноклональных антител. Наиболее распространенными методами тестирования продуктов секреции гибридомных клеток являются методы иммуноанализа на основе ферментных и флуоресцентный меток. Тестирование моноклональных антител против клеточно-ассоциированных антигенов проводят непрямой иммунофлуоресценцией на живых или фиксированных клетках. Поиск моноклональных антител, направленных против антигенов клеточной поверхности, проводят микроцитотоксическим тестом. Выявление культур, синтезирующих специфические иммуноглобулины, является лишь первым этапом отбора растущих гибридов. Расширенный скрининг заключается в проведении как позитивного, так и негативного отбора, с целью выявить наличие специфических взаимодействий моноклональных антител с другими антигенами.
Так как все гибридомные клетки анеуплоидны, им присуща генетическая нестабильность и тенденция к выщеплению вариантов, утративших способность синтезировать иммуноглобулины. Основная потеря хромосом гибридомами происходит в течение первого месяца после слияния, затем в процессе длительного культивирования отмечается постепенная сегрегация хромосом. Клонирование является основным методом получения стабильных гибридомных штаммов. Этот процесс облегчает использование клеточного сортера. Однако, в практике довольно широко применяется более дешевые методы, такие как – клонирование в жидкой среде методом лимитирующих разведений. Процедура состоит в рассеве клеток с убывающей концентрацией.
Полученные генетически стабильные штаммы гибридом используют для выделения целевого продукта в необходимых количествах. Существуют два пути наработки моноклональных антител в больших количествах. Первый заключается в массовом культивировании in vitro. Метод имеет ряд недостатков, связанных с необходимостью выщепления сыворотки из компонентов среды. Решением этой проблемы стало внедрение бессывороточных сред, содержащих различные компенсирующие компоненты (инсулин, трансферрин). Для массового культивирования гибридом в ферментерах необходима длительная адаптация гибридомных штаммов, некоторые штаммы не удается адаптировать и их продолжают выращивать методом пассирования на животных.
Альтернативный путь наработки моноклональных антител применяется только в странах, в которых не приняты правила гуманного обращения с животными, в частности в России. Метод основывается на опухолевой природе гибридом и их способности расти в сингенных животных. Для получения больших объемов жидкости, содержащей моноклональные антитела, гибридомы вводят внутрибрюшинно мышам реципиентам. В результате в брюшной полости вырастает солидная опухоль и возможно накопление асцитической жидкости, являющейся источником моноклональных антител. Увеличить количество асцита, содержащего моноклональные антитела, можно путем внутрибрюшинного введения нетоксического масла за несколько дней до инокуляции гибридом. Однако, в организме мыши-реципиента развитию гибридомной опухоли противодействует ряд факторов. Во-первых, естественная резистентность организма, опосредованная NK клетками, активирующимися в ответ на различия в экспрессии молекул гистосовместимости. Во-вторых, активация Т лимфоцитов в ответ на опухолевые антигены. В-третьих, синтез антиидиотипических антител. Возможна еще активация антивирусного иммунного ответа, при наличии вируса в гибридомных клетках. Первостепенной задачей исследователей было разрешение проблемы сингенности клеток опухоли и организма реципиента. Одним из таких решений было использование бестимусных мышей.
Из двух перечисленных методов наработки моноклональных антител второй является наиболее продуктивным: выход моноклональных антител 1-25 мг/мл при культивировании in vitro и 20-100 мкг/мл при массировании гибридом на животных.
Таким образом, мы видим, что процесс создания моноклональных антител является трудоемким процессом. Однако, преимущества их использования во много раз окупают затраты. Моноклональные антитела стандартны в своих свойствах и могут быть получены в неограниченных количествах; обладают абсолютной специфичностью к одному эпитопу целевого антигена; изменение конфигурации эпитопа коррелирует со снижением сродства моноклональных антител к эпитопу; возможно создание моноклональных антител против ранее неизвестных антигенов.
we pick up optimal solution for your task in accordance with world practice and affordable budget: