Абрамова О.А., Фомина Ю. А. Исследование выделенных клеток из пульпы третьего маляра человека с целью подтверждения их природы как мезенхимальных стволовых клеток.
Для подтверждения природы выделенных из пульпы зуба клеток был проведен ряд исследований.
Оценка пролиферативной активности МСК
После получения первичной культуры фибробластоподобных клеток, их необходимо пассировать по стандартной методике 2-3 раза. Оценку МСК проводили на 2-3 пассаже, это нужно для получения максимально чистой линии клеток. Для оценки пролиферативной активности МСК использовали построение кривой роста и расчет времени удвоения популяции клеток. Для этого проводили подсчет общего количества МСК в культуре на каждом пассаже.
Построение кривой роста проводили прямым соотношением общего числа МСК в культуре с числом дней культивирования.
Время удвоения популяции МСК рассчитывали, используя следующую формулу:
Тудв. = (Т2-Т1) / [(Log10N2 – Log10N1) × 3,32],
где N2 – количество собранных клеток, а N1 – количество посаженных клеток, а (Т2-Т1) – время между пассажами.
Для расчета показателя удвоения популяции использовали следующая формула:
Х = (Log10 N2 – Log10 N1) / Log10 2, где N2 – количество собранных клеток, а N1 – количество посаженных клеток.
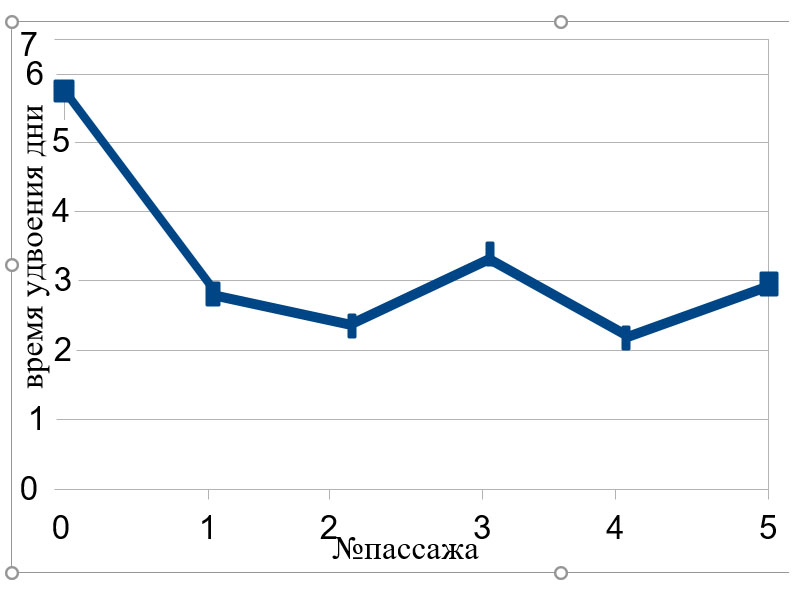
На Рисунке 1 видно, что на 0 пассаже клеток значительно больше за счет примесей других, не пассируемых первичных клеток. На 1 и 2 пассаже культура МСК приобретает устойчивость и воспроизводимость. 3 пассаж у большинства культур МСК является пиковым по пролиферации и колониеобразованию. Полученная кривая роста, дает основания полагать, что исследуемая культура относится к мезенхимально-стволовым клеткам.
Анализ колониеобразующих единиц (CFU)
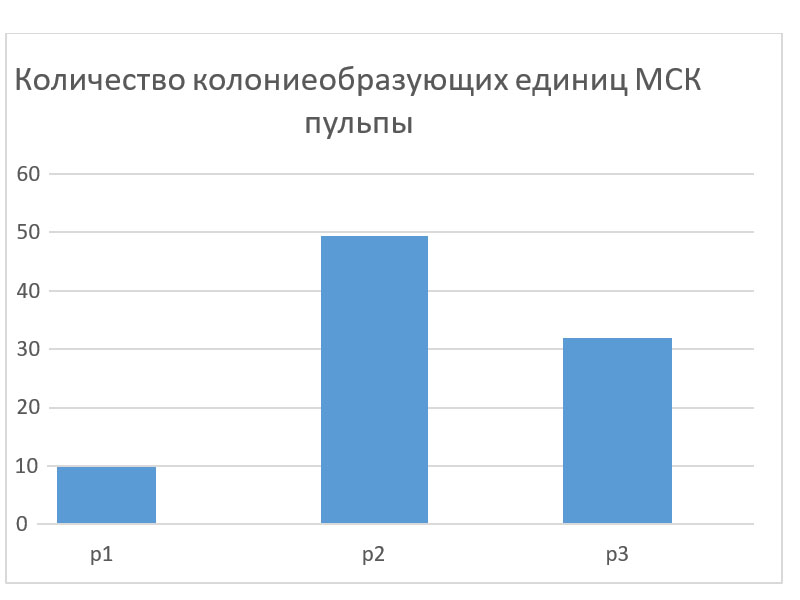
Исследуемые клетки высаживали на 96 луночный планшет методом серийных разведений. Далее эти планшеты использовали для запуска остеогенной и адипоцитарной дифференцировок. Рассчитанное значение колониеобразующих единиц на пассаже 1 – 9,761; на пассаже 2 – 48,986; на пассаже 3 – 33,217.
Иммунофенотипический анализ МСК
Анализ клеток проводили на 2-3 пассажах. В состоянии 70 – 80 % конфлюентного монослоя, клетки снимали с культурального пластика раствором 0,25 % трипсина
с фиксацией 4 % параформальдегидом (Merck, Германия), промывка фосфатно-солевым буфером и инкубация с моноклональными антителами к поверхностным маркерам, конъюгированными с флуорохромами CD73 , CD90 CD105. Исследование выполняли на проточном цитофлуориметре-сортере Guava easyCyte. В качестве отрицательного контроля были использованы линейные клетки HeLa. Исследуемые МСК показали положительную окраску на данные маркеры (Рисунок 3).
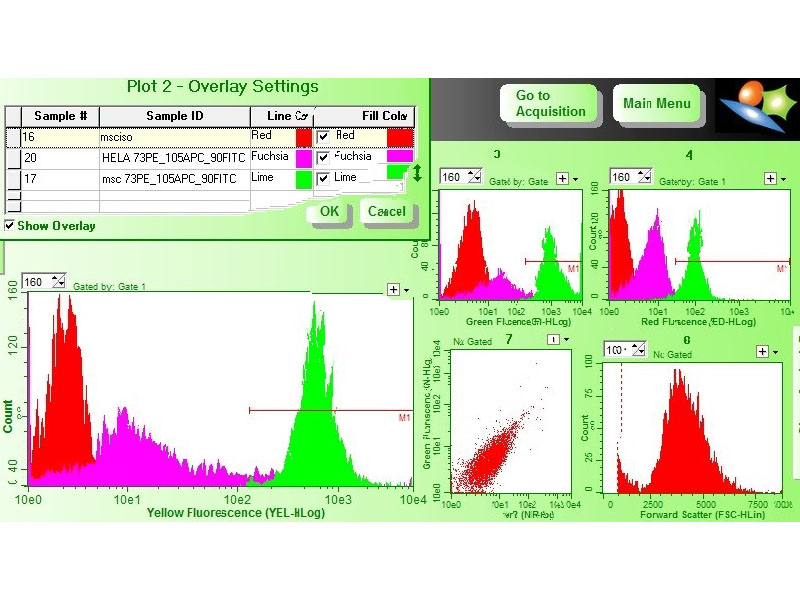
Полученные данные указывают на фибробластоподобную природу исследуемых клеток. Для подтверждения стволовости клеток будет использован метод запуска дифференцировки в остеогенном и адипоцитарном направлениях.
Оценка пластичности МСК
Оценку пластичности МСК производили путем направленной дифференцировки МСК in vitro в остеогенном и адипогенном направлении.
Остеогенная дифференцировка:
Диффренцировку МСК в остеогенном направлении запускали стандартными методом, добавлением в среду культивирования следующих компонентов:
1 мкM дексаметазона; 0,2 мM аскорбиновой кислоты; 1 мM β-глицеролфосфата. Клетки культивировали в присутствие индукторов дифференцировки в течение 20-21 дней.
Далее клетки отмывали от среды холодным фосфатно-солевым буфером и фиксировали охлажденным при минус 20 ºС 95 % спиртом (100 мкл/лунка) при комнатной температуре в течение 30 минут. Далее удаляли содержимое из лунок, промывали дистиллированной водой и вносили краситель Alizarin-Red (Sigma). Инкубировали
15-20 минут, затем краситель удаляли, тщательно промывали лунки фосфатно-солевым буфером, оставляли в 100 мкл воды и анализировали под микроскопом (Рисунок 4).
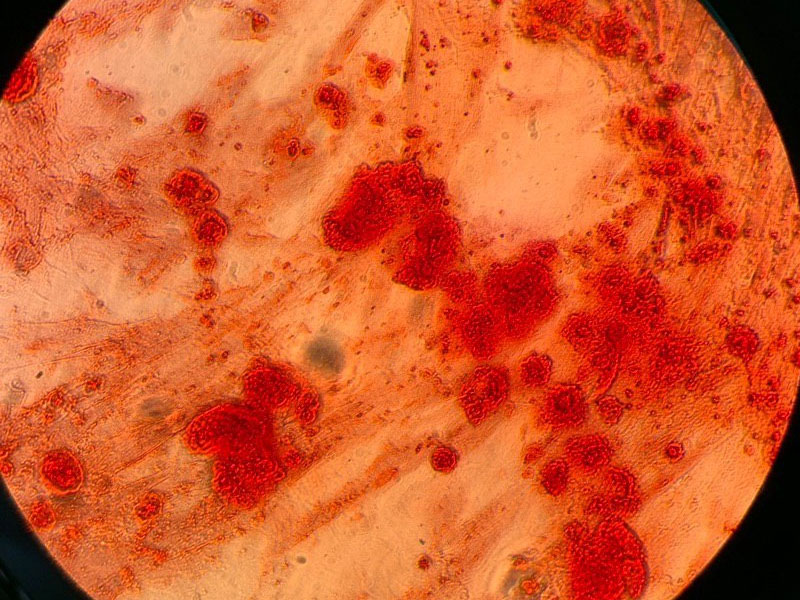
На Рисунке 4 можно видеть клетки с красными гранулами остеокальцита, что говорит о дифференцировке МСК в остеогенном направлении.
Адипогенная дифференцировка:
Дифференцировку МСК в адипогенном направлении запускали добавлением в среду культивирования следующих компонентов: 1 мкM инсулина, 1 мкM дексаметазона и 0,5 мкM 3-изобутил-1-метилксантина. Клетки культивировали в присутствие индукторов дифференцировки в течение 2 недель.
Спустя 2 недели среду из лунок удаляли, промывали фосфатно-солевым буфером (ФСБ) и вносили в лунки 4 % парафармальдегид (ПФА) и инкубировали при комнатной температуре 30 минут-1 час. Далее удаляли содержимое из лунок, промывали ФСБ и вносили краситель Ole-Red (Sigma). Инкубировали 15-30 минут, затем краситель удаляли, тщательно промывали лунки ФСБ и анализировали под микроскопом.
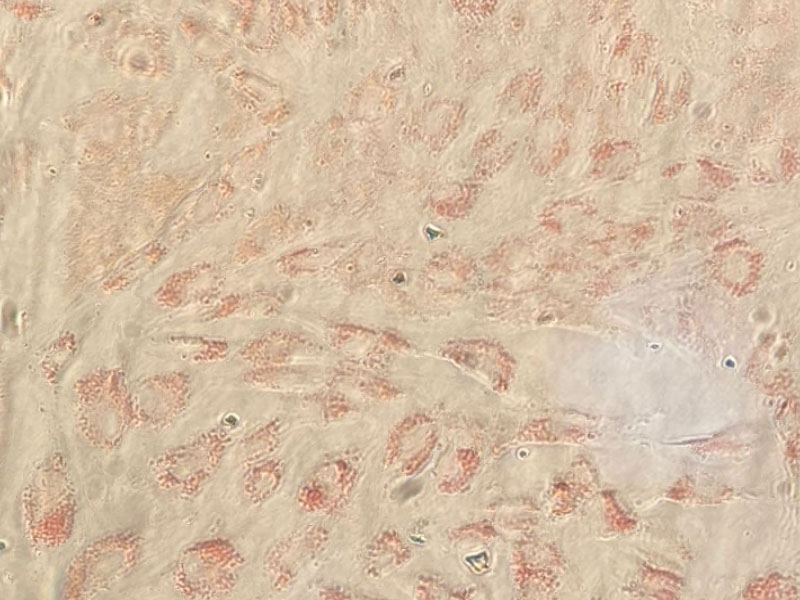
На Рисунке 5 мы видим, что клетки дифференцировались в адипогенном направлении и начали накапливать жир.
Таким образом, исходя из результатов дифференцировки клеток в остеогенном и адипогенном направлениях, можно сделать вывод, что выделенная культура клеток относится к мезенхимальным стволовым клеткам пульпы зуба.